Introducción.
La
reacción inflamatoria se desencadena cuando las células de los tejidos
afectados por un proceso infeccioso liberan sustancias como la histamina o la
serotonina (atraen a células fagociticas y son vasodilatadores al mismo
tiempo).
La
inflamación se debe al aumento de la permeabilidad capilar, que permite al
plasma escaparse desde los capilares al espacio intersticial.
El enrojecimiento se produce como consecuencia del incremento del flujo sanguíneo que llega a la zona afectada.
Otros efectos son el calor local y el dolor. La sangre trae a la zona una gran cantidad de células fagocíticas que haces su labor, lo que se pone en evidencia por la presencia de pus (células muertas, bacterias muertas y glóbulos blancos).
La fagocitosis es un proceso en el que los fagocitos engloban a los microorganismos formando vacuolas fagocíticas a las que luego vierten enzimas de sus lisosomas. Así se digieren los patógenos y sus restos son expulsados al exterior.
Inflamación y fagocitosis, Aspectos inmunológicos
Inflamación:
Reacción de tabicación o aislamiento debido a daño tisular a causa de una
herida o patógeno invasor.
Signos cardinales: rubor,
tumor, calor, dolor y pérdida de la función del área afectada.
Fenómenos de inflamación:
Vasodilatación capilar.-
Debido a la vasoconstricción del sistema de drenaje venoso del área
afectada, lo que produce ingurgitación capilar y con ello un enrojecimiento (rubor,
eritema) y elevación de la temperatura (calor).
Aumento de permeabilidad capilar.-
La congestión capilar y la afluencia de fagocitos producen un incremento
en la presión hacia el espacio intersticial, lo que modifica las deltas de
intercambio y facilita el paso de líquido rico (exudado) o pobre (trasudado) en
proteínas. Lo que traduce en edema y, con ello, Entumecimiento.
Quimiotaxis.-
A partir de la liberación de citocinas del tejido afectado a circulación
que induce la migración por gradiente de concentración hacia el tejido
afectado. Comienza por la adhesión (marginación) a través de selectinas al
endotelio, seguido por un proceso de rodación hasta las vénulas post acapilares
del tejido afectado donde comienza la transmigración o
extravasación(diapédesis) entre las células endoteliales por intervención de integrinas,
proceso que promueve el incremento de permeabilidad vascular. A medida que
comienza la fagocitosis del agente patógeno, se liberan enzimas líticas que
pueden dañar células cercanas sanas y estimular las terminales nerviosas, lo
cual traduce
Dolor.
Mediadores químicos de la inflamación
(Proteínas de fase aguda)
Proteína
Creactiva.-
Liberada por el
hígado, que al unirse al componente polisacárido C de la pared bacteriana
activa el complemento que induce incremento en la eliminación del agente
patógeno sea por opsonización-fagocitosis o por lisis por MAC (C5b-C9).
Histamina.-
Liberada por células de tejidos dañados, se une areceptores capilares y
provoca vasodilatación y aumento en la permeabilidad capilar.
Cininas.-
Se encuentran normalmente de forma inactiva en plasma sanguíneo, la
lesión estimula a estos péptidos y causan vasodilatación y aumento en la
permeabilidad capilar
Fagocitosis:
-La
fagocitosis es la ingestión de microorganismos o partículas de materia
resultantes de la rotura del tejido por los leucocitos polimorfonucleares,
monocitos o fagocitos hísticos. El proceso de fagocitosis incluye los procesos
de opsonización (recubrimiento de inmunoglobulinas o complemento a las
bacterias o antígenos), ingestión (después de la fijación la bacteria es
incorporada a la célula, rodeándola con seudópodos del fagocito), y por último
destrucción de las bacterias o antígenos (degradación por enzimas, pH ácido en
la vacuola, proteínas catiónicas, lactoferrinas, anión superóxido o peróxido de
hidrógeno).
Cuando las bacterias o los antígenos agresores son destruidos, puede comenzar el proceso de la curación.
Cuando las bacterias o los antígenos agresores son destruidos, puede comenzar el proceso de la curación.
-Es el
proceso por el cual células especializadas buscan, localizan, identifican e introducen a su citoplasma
partículas, gérmenes o células extrañas
para destruirlos y extraer de ellos los antígenos que se deben presentara los
linfocitos.
Mecanismo innato de
defensa que consiste en la digestión de material extracelular.
Se expande la membrana
plasmática de la célula alrededor de material particulado para formar vesículas
denominadas fagosomas. Posteriormente se lleva a cabo la unión con un lisosoma
para formar un fagolisosoma, en el cual, el agente ingerido es disuelto por
enzimas hidrolíticas o especies reactivas de oxígeno por acción de la explosión
respiratoria.
Principalmente participan
macrófagos, neutrófilos y eosinófilos
(fagocitos).
Este proceso se puede ver
potenciado por efecto de Ac que actúan como opsoninas para amplificar su
velocidad y potencia en los fagocitos.
Forma de internalización
celular para la captura de partículas grandes (>0,5 de espesor) por un mecanismo
dependiente de actina.
Interviene en:
Captura y
degradación de agentes infecciosos y células seniles. Interviene en el desarrollo
y remodelamiento de tejidos. Participa en la respuesta inmune específica y en la
inflamación.
QUIMIOTAXIS
La quimiotaxis se presenta como un proceso fisiológico en donde el glóbulo blanco combate las sustancias patógenas que han producido inflamación, este glóbulo se margina del flujo sanguíneo, que en estas zonas de inflamación es turbulento, luego se adhiere a la pared del vaso y transmigra a través de este para llegar a los entes patógenos para fagocitarlos. Este proceso es considerado desde los fenómenos de transporte electroquímico, flujos eléctricos y de concentración, entre otros.
ADHERENCIA
Otros receptores sobre la membrana de los leucocitos y otros fagocitos actúan como mecanismos de adherencia sobre los microorganismos, sea a productos microbianos específicos o sobre opsoninas del sistema inmune del hospedador como:
-Receptor de manosa. Este receptor tiene afinidad por los componentes de manosa presentes en las glucoproteínas y glucolípidos de las paredes celulares microbianos.
-Scavenger. Estos receptores se unen directamente a microorganismos y a moléculas de LDL modificadas.
-CD14. Es un ligando con preferencia específica al lipopolisacárido presente en ciertas bacterias y está asociado a un receptor tipo Toll.
Otros receptores sobre la membrana de los leucocitos y otros fagocitos actúan como mecanismos de adherencia sobre los microorganismos, sea a productos microbianos específicos o sobre opsoninas del sistema inmune del hospedador como:
-Receptor de manosa. Este receptor tiene afinidad por los componentes de manosa presentes en las glucoproteínas y glucolípidos de las paredes celulares microbianos.
-Scavenger. Estos receptores se unen directamente a microorganismos y a moléculas de LDL modificadas.
-CD14. Es un ligando con preferencia específica al lipopolisacárido presente en ciertas bacterias y está asociado a un receptor tipo Toll.
INGESTIÓN
La unión a receptores de adherencia promueve señales de comunicación intracelular que resultan en la invaginación de la membrana del fagocito rodeando al receptor y su ligando patogénico. Al rodear por completo al complejo receptor: molécula, la membrana se une en sus extremos y libera al interior de la célula un fagosoma. Esto puede ocurrir en más de un punto de la membrana celular.
La unión a receptores de adherencia promueve señales de comunicación intracelular que resultan en la invaginación de la membrana del fagocito rodeando al receptor y su ligando patogénico. Al rodear por completo al complejo receptor: molécula, la membrana se une en sus extremos y libera al interior de la célula un fagosoma. Esto puede ocurrir en más de un punto de la membrana celular.
DIGESTIÓN
Una vez que el fagosoma está en el citoplasma comienza la desintegración del mismo, proceso que se realiza por mecanismos dependientes o independientes de Oxígeno. El primero se da tras activarse rutas metabólicas que consumen oxigeno, lo cual produce la liberación de radicales libres del oxígeno, que son tóxicos para los microorganismos. En el segundo caso es donde intervienen los lisosomas, los cuales se unen al fagosoma conformando un fagolisosoma, y liberando enzimas hidrolíticas que destruirán al antígeno.
Una vez que el fagosoma está en el citoplasma comienza la desintegración del mismo, proceso que se realiza por mecanismos dependientes o independientes de Oxígeno. El primero se da tras activarse rutas metabólicas que consumen oxigeno, lo cual produce la liberación de radicales libres del oxígeno, que son tóxicos para los microorganismos. En el segundo caso es donde intervienen los lisosomas, los cuales se unen al fagosoma conformando un fagolisosoma, y liberando enzimas hidrolíticas que destruirán al antígeno.
EXCRECIÓN
En el proceso de digestión queda una vesícula que contiene desechos, o el mismo antígeno (Dado que no siempre puede ser desintegrado), por lo que esto debe estar fuera de la célula para traer futuros inconvenientes. Entonces, la forma de deshacerse de estos residuos es mediante la exocitosis (es el proceso celular por el cual las vesículas situadas en el citoplasma se fusionan con la membrana citoplasmática y liberan su contenido. Esto sucede cuando llega una señal extracelular).
En el proceso de digestión queda una vesícula que contiene desechos, o el mismo antígeno (Dado que no siempre puede ser desintegrado), por lo que esto debe estar fuera de la célula para traer futuros inconvenientes. Entonces, la forma de deshacerse de estos residuos es mediante la exocitosis (es el proceso celular por el cual las vesículas situadas en el citoplasma se fusionan con la membrana citoplasmática y liberan su contenido. Esto sucede cuando llega una señal extracelular).
Inflamación
La inflamación es la respuesta del sistema inmunologico a invasores extraños tales como virus y bacterias. Como respuesta a la infección o la lesión, diversas clases de glóbulos blancos se transportan por el torrente sanguíneo hasta el lugar de la infección y solicitan más glóbulos blancos. La inflamación suele ceder cuando la amenaza de infección o lesión desaparece. Por ejemplo, cuando una persona se corta o tiene gripe, la inflamación se usa para matar la bacteria o el virus que invade el cuerpo.
La inflamación es la respuesta del sistema inmunologico a invasores extraños tales como virus y bacterias. Como respuesta a la infección o la lesión, diversas clases de glóbulos blancos se transportan por el torrente sanguíneo hasta el lugar de la infección y solicitan más glóbulos blancos. La inflamación suele ceder cuando la amenaza de infección o lesión desaparece. Por ejemplo, cuando una persona se corta o tiene gripe, la inflamación se usa para matar la bacteria o el virus que invade el cuerpo.
La inflamación puede producir:
-Dolor
-Enrojecimiento
-Rigidez o pérdida de la movilidad
-Hinchazón
-Calor
Cuando un tejido es dañado, por un golpe, por ejemplo, sus células liberan una sustancia llamada histamina, que produce la dilatación de los vasos sanguíneos y, por consiguiente, el aporte de grandes cantidades de sangre hacia el área afectada. Además, los tejidos inflamados liberan líquido intracelular, conocido como exudado inflamatorio, que puede acumularse infiltrando los tejidos y dificultando o imposibilitando el funcionamiento del órgano o de la región afectada.
Las inflamaciones pueden ser agudas o crónicas. Son agudas cuando presentan un período de hinchazón, dolor e incapacidad crecientes, que luego disminuyen en poco tiempo; se denominan crónicas cuando se prolongan durante meses o años, presentando períodos de mayor o menor intensidad, de acuerdo con factores como la humedad, la dieta o estado del propio sistema inmunitario.
La gravedad, la duración y las características peculiares de cada respuesta inflamatoria dependen del área afectada, de su estado previo y de la causa que la provoca.
-Agentes vivos: bacterias virus, parásitos, hongos
-Agentes físicos: radiaciones, frío, calor, ultravioletas.
-Agentes químicos: venenos, toxinas.
-Traumatismos y cuerpos extraños.
-Alteraciones vasculares: como por ejemplo las que producen isquemia.
Dependiendo de las características temporales de la inflamación definimos dos tipos de respuesta, inflamación aguda e inflamación crónica.
MIGRACIÓN AL FOCO INFLAMATORIO:
FAGOCITOSIS
PRODUCCIÓN DE MEDIADORES INFLAMATORIOS
Conlleva a
la respuesta inmune específica
Mediadores producidos por macrófagos:
Interferones(,)
Factores Estimulantes
de Colonia(GM,M,G,otros)
Interleucinas
(1,6,8,10,12)
Quimiocinas
TNF
Factor de
Crecimiento derivado de Plaquetas
PAF
TGF
Derivados
del AA
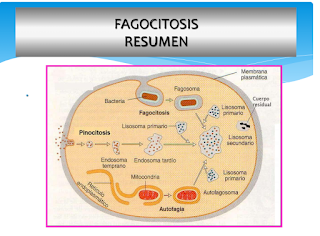
ETAPAS DE LA FAGOCITOSIS
MADURACIÓN DEL FAGOSOMA
Es el proceso
que cumple el fagosoma traficando por los microtúbulos, a través de la fusión y
fisión con endosomas y finalmente con lisosomas hasta formar el fagolisosoma. La
tasa de ésta varía según la naturaleza de la interacción entre la superficie de
la partícula y la membrana fagosomal. La transferencia del contenido entre lisosomas
y el fagosoma se cree realizado por puentes acuosos estrechos que solo permiten
un intercambio limitado. Aún el fagolisosoma continúa fusionándose con otros lisosomas.
FAGOCITOSIS
FORMACION DEL FAGOSOMA